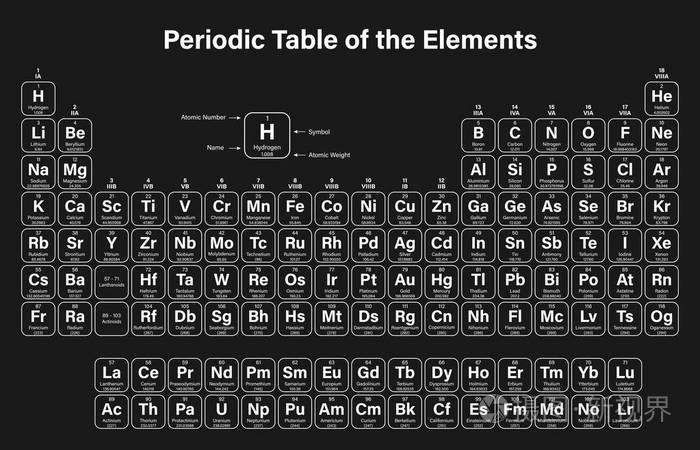
高中化学选修三第二章——元素周期律与元素周期表
谢谢您关注中学物理公众号,如您仍未关注,点击标题下方"中学物理”关注我们,即可获取教育经验、方法、学习资料等,每晚与您相约!
元素是物理学习的基础,元素周期表里包含的内容贯串了整个中学物理的知识体系,明天化学姐给朋友们总结了中学物理必修三的第二章元素周期表和元素周期律的知识汇总,近来有些朋友们正在学习这一部份知识,这么那些朋友们一定要仔细阅读哦~
元素周期律和元素周期表知识总结
首先一上去看考试要求
1.理解原子的组成及核素的概念。把握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的互相关系。
2.以第1、2、3周期的元素为例,把握核外电子排布规律。
3.把握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
4.以第3周期为例,把握同一周期内元素性质(如:原子直径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA族和ⅦA族为例,把握同一主族内元素性质递变规律与原子结构的关系。
知识规律总结一、原子结构
1.几个量的关系()
质量数(A)=质子数(Z)+中子数(N)
质子数=核电荷数=原子序数=原子的核外电子数
离子电荷数=质子数-核外电子数
2.核素
(1)要点:同——质子数相同,异——中子数不同,微粒——原子。
(2)特性:核素的物理性质几乎完全相同;自然界中稳定核素的原子个数百分率不变。
注意:同种元素的核素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。
3.相对原子质量
(1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。它是相对质量,单位为1,可忽视不写。
(2)元素的相对原子质量:是按该元素的各类核素的原子比率与其相对原子质量的乘积所得的平均值。元素周期表中的相对原子质量就是指元素的相对原子质量。
4.核外电子排布规律
(1)核外电子是由里向外,分层排布的。
(2)各电子层最多容纳的电子数为2n2个;最内层电子数不得超过8个,次内层电子数不得超过18个,倒数第三层电子数不得超过32个。
(3)以上几点相互联系。
核外电子排布规律是书写结构示意图的主要根据。
5.原子和离子结构示意图
注意:①要熟练地书写1~20号元素的原子和离子结构示意图。
②要正确分辨原子结构示意图和离子结构示意图(通过比较核内质子数和核外电子数)。
6.微粒直径大小比较规律
(1)同周期元素(稀有二氧化碳除外)的原子直径随原子核电荷数的递增逐步降低。
(2)同主族元素的原子直径和离子直径随着原子核电荷数的递增逐步减小。
(3)电子层结构相同的离子,核电荷数越大,则离子直径越小。
(4)同种元素的微粒直径:阳离子Al>Si>P>S>Cl
③同主族元素(比较原子和离子直径):随原子序数的减小,原子的原子直径依次减小。如:Li,F--
--
④同电子层结构(阳离子的电子层结构与上一周期0族元素原子具有相同的电子层结构,阴离子与同周期0族元素原子具有相同的电子层结构):随核电荷数减小,微粒直径依次降低。如:F->Na+>Mg2+>Al3+
(3)元素金属性强弱的判定方式
(4)非金属性强弱的判定方式
思维方法点拨一、有关微粒质量数、质子数、中子数和核电荷数的推测
【例1】设某元素某原子核内的质子数为m,中子数为n,则下列论断中正确的是
A.不能由此确定该元素的相对原子质量B.这些原子的相对原子质量为m+n
C.若碳原子质量为wg,此原子的质量为(m+n)wgD.核内中子的总质量大于质子的质量
【解析】元素的相对原子质量和原子的相对原子质量是两个不同的概念,要求元素的相对原子质量,必须晓得其各类核素的相对原子质量和原子个数百分率,否则难以求解,故选项A正确。质子数m+中子数n应为质量数,不是相对原子质量,选项B错误。由相对原子质量的物理表达式可知,某原子的质量=×一种碳原子质量×该原子的相对原子质量,故选项C错误。1个质子的质量略大于1个中子的质量,但核内质子的总质量与中子的总质量还要取决于质子和中子数量的多少,选项D错误。
本题正确答案为A。本题要求熟悉有关的基本概念,要注意分辨一些易混淆的概念,如相对原子质量与质量数,元素的相对原子质量与原子的相对原子质量,同位素与核素等。
二、根据元素周期律知识推测元素及化合物的性质
【例2】砹(At)是原子序数最大的卤族元素,猜想砹或砹的化合物不可能具有的性质是()A.HAt很稳定B.易溶于个别有机溶剂C.AgAt不溶于水D.是有色固体
【解析】由题意,砹在周期表中与碘相邻,故它的性质与碘具有相像性,但它的非金属性应比碘弱。HAt的稳定不如HI,故选项A错误;碘易溶于个别有机溶剂,则砹也应溶化;AgI不溶于水,则AgAt也不溶于水;碘是紫红色固体,按照相像性砹也是有色固体。
本题正确选项为A。
三、有关核素的估算
【例3】铜有两种天然核素和物质结构元素周期律,参考铜的原子量(63.5)计算的百分浓度约是()A.20%B.25%C.50%D.66.7%E.75%
【解析】用十字交叉法可求得两种核素的原子个数比
即与的原子个数比为1∶3,所以%=×100%=25%,故应选B。
四、推断元素原子序数差
【例4】若短周期中的两种元素可以产生原子个数比为2∶3的化合物,则这两种元素的原子序数之差不可能是()
A.1B.2C.5D.6
【解析】设两种元素的符号分别为X和Y,则化合物的物理式为X2Y3,即X为+3价,Y为-2价,在短周期元素中满足此要求的X元素有5B、7N、13Al,Y元素有8O和16S,原子序数差值见下表
本题正确答案为D。
五、微粒大小比较
【例5】X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子直径小于Y元素的阳离子直径,Z和Y两元素的原子核外电子层数相同,Z元素的原子直径大于Y元素的原子直径。X、Y、Z三种元素原子序数的关系是()
A.X>Y>ZB.Y>X>ZC.Z>X>YD.Z>Y>X
【解析】对于电子层结构相同的离子,核电荷数越大,直径越小,现X元素的阳离子直径小于Y,故核电荷数应是Y>X。Z和Y的电子层数相同,则它们在同一周期,随着核电荷数的递增,原子直径逐步减少,现Z的原子直径大于Y,则核电荷数Z>Y。综合以上关系得Z>Y>X。
本题正确答案为D。
六、原子结构知识的综合推算
【例6】周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最内层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是、、(填元素符号)。
【解析】本题采用平均值法解答比较简单。由A、B、C三元素为相邻元素以及它们的平均质子数41/3≈14
【例7】已知某主族金属元素X的原子核内质子数和中子数之比为1∶1,含该金属阳离子0.192g的氨水正好能将20mL0.4mol/L的氨水中的CO32-全部沉淀,推测X是哪些元素及在周期表中的位置。
【解析】周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。设金属的相对原子质量为M,由关系式X2+~得物质结构元素周期律,M∶1=0.192∶(0.4×0.02),解得M=24。则X为镁,坐落第3周期第ⅡA族。
- 上一篇: 姜育恒 - 烛光里的妈妈歌词是什么?
- 下一篇: 三大战役辽沈战役电影完整版